昨年度までは「家畜栄養学実験」として後期に7回行っていた授業ですが
今年度からは名前を「家畜栄養生理学実験」と改め、前期に15回の実験を行います。
慣れない実験に戸惑いながらも、がんばる初々しい3年生の模様をお伝えします。
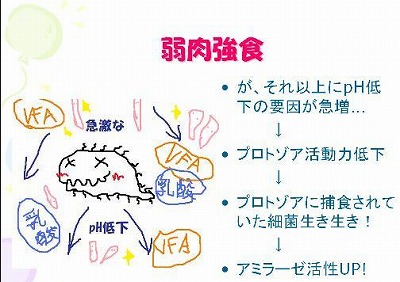
第1回 ルーメン液のサンプリング、pH測定およびプロトゾア観察
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
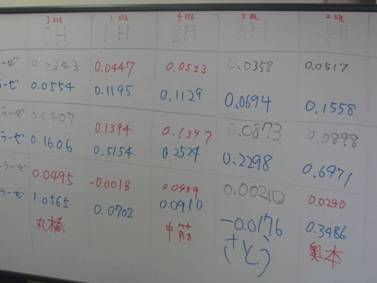
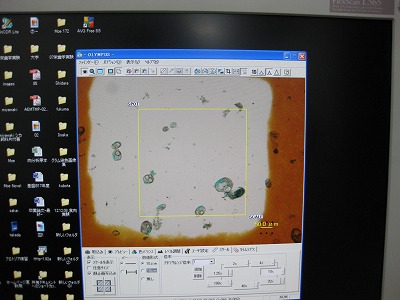
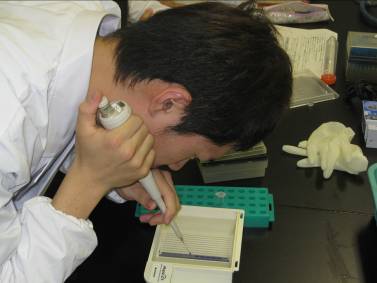
初回は、給餌前と給餌後1~4hにルーメン液をサンプリングし、pHを測定し、プロトゾアを観察しました。
初回の栄養生理学実験は以上です。粗飼料多給個体と濃厚飼料多給個体のルーメン液性状の違いを肌で(鼻で?)感じてもらえたでしょうか?
次回からはサンプリングしたルーメン液を分析し、両個体のルーメン内が栄養学的にどのように違うのか検証します。
番外編
先生もTAも久々に新鮮なプロトゾアを観察でき、3年生と同様に楽しめる実験でした。
次回もお楽しみに!
(担当:ふくま)
第2回 アンモニア態窒素濃度の測定
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
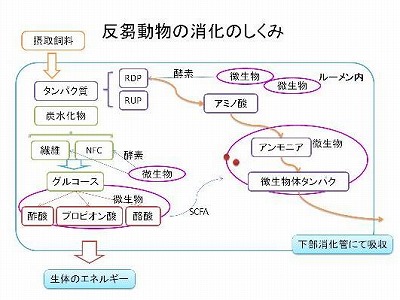
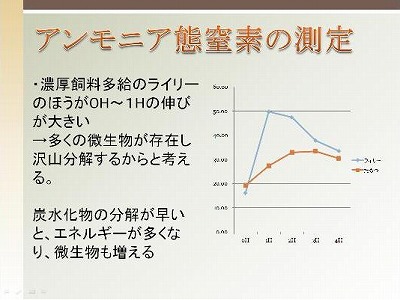
今回はルーメン液中のアンモニア態窒素濃度を測定することで、微生物タンパク質の合成に十分な量のアンモニアが存在することを確認します。そして、その経時変化を調べることでルーメン内でのタンパク質利用(タンパク質が分解された後、どのように利用されるか?)について考えます。
第2回の栄養生理学実験は以上です。粗飼料多給個体と濃厚飼料多給個体のルーメン内でのタンパク質分解の様子を捉えることはできたでしょうか。また、ルーメン微生物の分解能力を目+鼻(笑)で感じることができましたね。
次回からはサンプリングしたルーメン液のアミラーゼ&セルラーゼの酵素活性を測定し、両個体でどのように違うのか検証します。
次回もお楽しみに!
(担当:林)
第3回 糖質分解酵素の活性測定
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
今回はルーメン液のセルラーゼおよびアミラーゼ活性を測定することで、ルーメン内で粗飼料および濃厚飼料が分解されることを実証します。
今回の栄養生理学実験は以上です。
次回はプロトゾアの計数とVFA濃度の測定を行います。
次回もお楽しみに!
(担当:内堀)
第4回 プロトゾア計数と短鎖脂肪酸(SCFA)濃度の測定
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
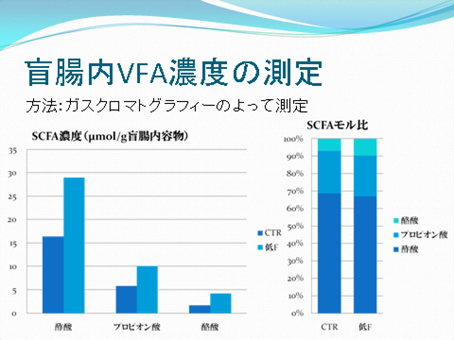
今回はルーメン内のSCFA濃度を測定することで、給与飼料の違いがSCFAの産生量、特に酢酸・プロピオン酸・酪酸の割合に及ぼす影響を明らかにします。
また、あわせてプロトゾアを計数することで、給与飼料が微生物数に及ぼす影響について考察します。
今回の栄養生理学実験は以上です。
次回はルーメン細菌からのDNA抽出、PCRおよび電気泳動を行います。
次回もお楽しみに!
(担当:すう)
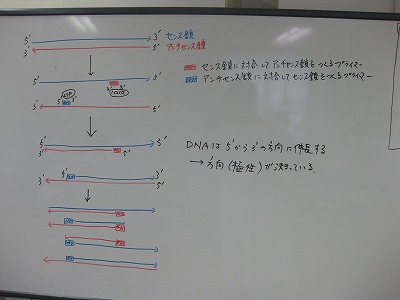
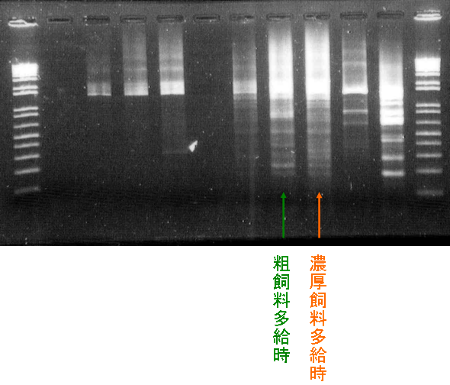
第5回 ルーメン細菌からのDNA抽出および16S rDNAのPCR増幅
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
今回と次回の2回にわたって、給与飼料の違いによるルーメン発酵パターンの変化を、DNAレベルで細菌叢の違いから検証します。
今回の栄養生理学実験は以上です。
次回は制限酵素消化によるルーメン細菌叢解析を行います。
次回もお楽しみに!
(担当:すう)
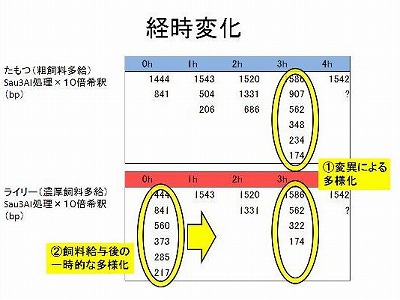
第6回 制限酵素消化によるルーメン細菌叢解析
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
これまでの実験で給与飼料の違いによりルーメン内の発酵パターンが変化することを確認してきました。これらはルーメン内に生息する微生物の構成が変化したことに起因するものであり、今回はDNAレベルで細菌叢の違いを確認しルーメン内での細菌叢変化に関する理解を深めるのが目的です。
今回の栄養生理学実験は以上です。
次回はいよいよ前半のまとめのプレゼンテーションです!これまでに得られた結果をまとめてしっかり考察を深めておいてください!
次回もお楽しみに!
(担当:内堀)
第7回 発表会(前半)
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
これまでの実験で給与飼料の違いによりルーメン内の発酵パターンが変化することを確認してきました。
また、なぜ変化が起きているのか、ルーメン内の微生物に注目して数・多様性・酵素活性を明らかにしてきました。
今回は前半のまとめとして、これまで行ってきた実験の結果・考察を、班ごとに発表してもらいました。
今回で栄養生理学実験の前半は終了です。
残り半分、この調子で頑張ってください!
次回からは後半の様子をお伝えします。
お楽しみに!
(担当:林)
第8回 ラットの群分け&サンプリング
お待たせしました!栄養生理学実験、後半の始まりです。
後半では単胃動物の代表としてラットを用いて2つの群に分け、通常の飼料と、食物繊維含量が極端に低い飼料を与えてその違いを探ります。
初回はまずラットの体重測定と群分け、そして2週間の飼育を通してサンプリングに至るまでの様子をご紹介します。
3年生、2週間のラットの飼育お疲れ様でした。次回からは今回サンプリングした血液と盲腸内容物の分析を行います。
それでは次回もお楽しみに!
(担当:ふくま)
第9回 血清成分の測定
後半第3回目は、血清中のグルコースおよびコレステロール濃度の測定を行いました。
3年生、お疲れ様でした。次回からは発酵産物の測定に入ります。
それでは次回もお楽しみに!
(担当:渡部)
第10回 盲腸内容物中のpHおよびアンモニア態窒素濃度の測定
後半第4回目は、盲腸内容物中のpHおよびアンモニア態窒素濃度の測定を行いました。
次回は、同じく盲腸内容物を用いてSCFA濃度を測定します。
加えて嫌気性細菌の計数に用いるロールチューブを作成します。
次回もお楽しみに!
(担当:林)
第11回 ラット盲腸内短鎖脂肪酸(SCFA)濃度の測定と嫌気性ロールチューブ法による腸内細菌の培養計数
後半第5回目は、短鎖脂肪酸(SCFA)濃度の測定を行い、産生した発酵産物の違いを検証しました。
また、盲腸内細菌の培養計数を行うため、嫌気性ロールチューブを作成しました。
次回は、作成したロールチューブのコロニーの計数とReal-time PCRによるラット盲腸内総細菌と乳酸菌の定量を行います。
次回もお楽しみに!
(担当:すう)
第12回 ロールチューブ法およびReal-time PCR法による腸内細菌の定量
本年度の栄養生理学実験、後半後半では単胃動物の代表としてラットを用いて2つの群に分け、通常の飼料と、食物繊維含量が極端に低い飼料を与えてその違いを探ります。
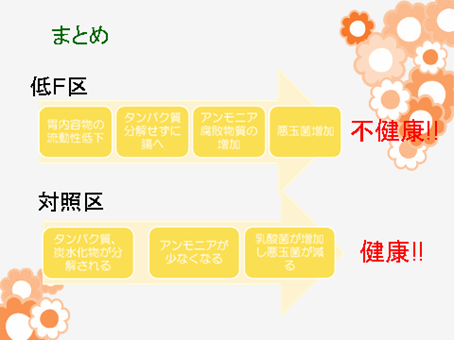
これまでの実験で給与飼料の違いにより血中成分や腸内の発酵パターンが変化することを確認してきました。これらは給与飼料の違いにより腸内に生息する微生物の構成が変化したことに起因するものだと考えられます。今回は2つの方法で腸内に生息する細菌の量を定量し、腸内の細菌叢変化に関する理解を深めるのが目的です。
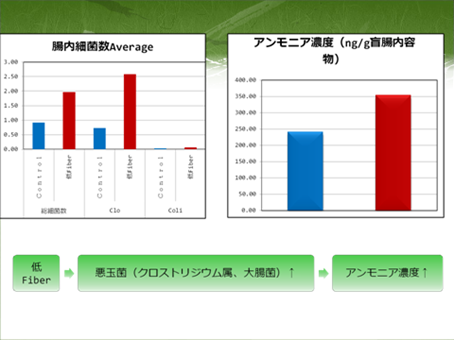
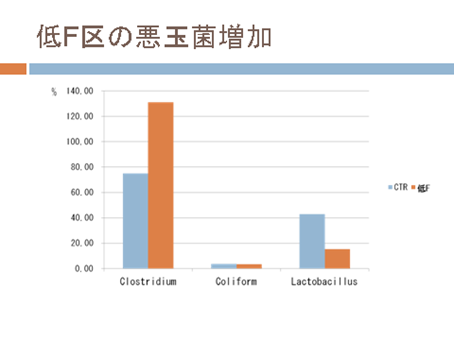
ロールチューブ法による総細菌、Clostridium 属細菌およびColiforms の定量
前回の実験では培地を作製し10倍希釈系列の盲腸内容物をそれぞれの培地に接種しておきました。それを37℃で2日ほど培養すると…
食物繊維の給与を減らしたラットの盲腸内でのClostridium 属細菌およびColiformsはそれぞれどのような変化をみせたでしょうか?
Real-time PCR法による総細菌およびLactobacillus 属細菌の定量
ロールチューブでの細菌計数と平行して培養を介さず細菌を定量できるReal-time PCR定量を行いました。
今回は嫌気性ロールチューブ法およびReal-time PCR法を用いて腸内でのClostridium 属、ColiformsおよびLactobacillus 属の増減を調べました。
それぞれ「どのような菌か?」また処理による影響があったなら「なぜそうなったか?」をしっかり考察しておいてください
今回の栄養生理学実験は以上です。
次回はいよいよ後半のまとめのプレゼンテーションです!これまでに得られた結果をまとめてしっかり考察を深めておいてください!
次回もお楽しみに!
(担当:内堀)
第13回 後半プレゼンテーション
本年度の栄養生理学実験、後半後半では単胃動物の代表としてラットを用いて2つの群に分け、通常の飼料と、食物繊維含量が極端に低い飼料を与えてその違いを探ります。
これまでの実験で給与飼料の違いにより血中成分や腸内発酵パターンおよび腸内菌叢が変化することを確認してきました。
今回は後半のまとめとして、これまで行ってきた実験について班毎に考察し発表してもらいました。
色々コメントもさせてもらいましたが、いずれの班もよく準備していて自分が3年生のときと比べるとビックリです。
その中でも5班の発表はプレゼンテーションの完成度として頭一つ抜け出した出来でした。
今後研究室に配属されるとプレゼンの機会もますます増えていくと思うのでさらに技術を磨いていってください。
今回の栄養生理学実験は以上です。
今年から「家畜栄養生理学実験」と名前を変え全15回となった学生実験もようやく終わりを迎えました。
さまざま実験を通して3年生はそれぞれどんなことを感じたでしょうか?
10月にはいよいよ研究室分属を控えますがどの研究室にいってもこの実験の経験がいきれば幸いです。
来年もお楽しみに!
(担当:内堀)