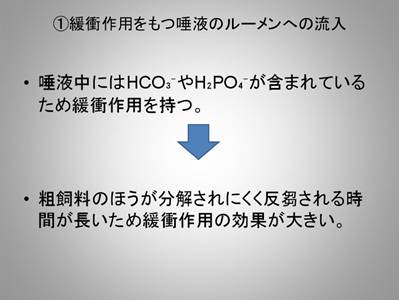
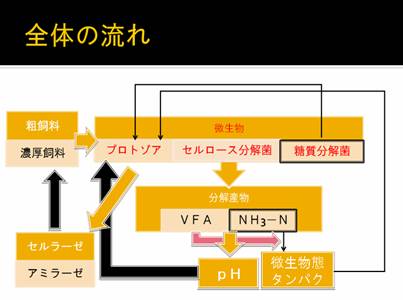
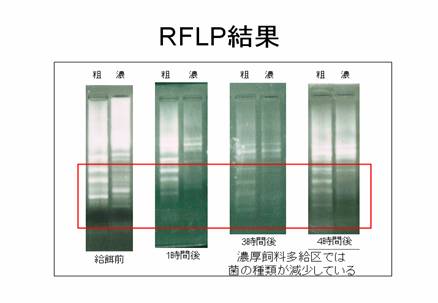
第1回 ルーメン液のサンプリング、pH測定およびプロトゾア観察
前半のヒツジ(ルーメン)編では、粗飼料を多給した区と濃厚飼料を多給した区を設定し、それらの飼料がお腹の中でどのように分解・発酵されていくのかを見ていきます。初回の実験では各ヒツジからルーメン液を採取し、pHを測定し、微生物の一種であるプロトゾアを観察しました。
なお、サンプリングは飼料摂取前後の変化を見るため、給餌前、給餌後1時間、2時間、3時間、4時間と5回に分けて行いました。
これからは今回サンプリングしたルーメン液を用いて、様々な分析を行っていきます。
次回もお楽しみに!
(担当:福間)
第2回 糖質分解酵素の活性測定
今回の栄養生理学実験は以上です。
来週はアンモニア態窒素濃度の測定を行います。
次回もお楽しみに!
(担当:林)
第3回 アンモニア態窒素濃度の測定
本年度の栄養生理学実験、前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
今回はルーメン液のアンモニア態窒素濃度を測定することで、微生物タンパク質の合成に十分な量のアンモニアが存在することを確認します。そして、その経時変化を調べることでルーメン内でのタンパク質利用(タンパク質が分解された後、どのように利用されるか?)について考えます。
今回の栄養生理学実験は以上です。
次回はSCFA濃度測定とプロトゾア計数を行います。
次回もお楽しみに!
(担当:林)
第4回 プロトゾア計数と短鎖脂肪酸 (SCFA) 濃度の測定
・・・この回は写真を撮り忘れたためありません。すみません。
第5回 ルーメン細菌からのDNA抽出、RFLPによる菌叢解析
本年度の栄養生理学実験の様子をお伝えします。
前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
今回はルーメンサンプル中に存在する遺伝子が、粗飼料多給区と濃厚飼料多給区で違いがあるかを確認します。
さらに経時変化を調べることでルーメン内での菌叢変化について考えます。
今回の栄養生理学実験は以上です。
次回はラットの体重測定・群分けを行います。
次回もお楽しみに!
(担当:さかき)
プレゼンテーション(前半)
本年度の栄養生理学実験の様子をお伝えします。
前半では粗飼料多給条件および濃厚飼料多給条件のヒツジのルーメン内発酵が時間経過とともにどのように変化するかを調べます。
これまでの実験で給与飼料の違いによりルーメン内の発酵パターンが変化することを確認してきました。また、なぜ変化が起きているのか、ルーメン内の微生物に着目して数・多様性・酵素活性を明らかにしてきました。
今回は前半のまとめとして、これまで行ってきた実験の結果・考察を班ごとに発表してもらいました。
第6回 ラットの群分け&サンプリング
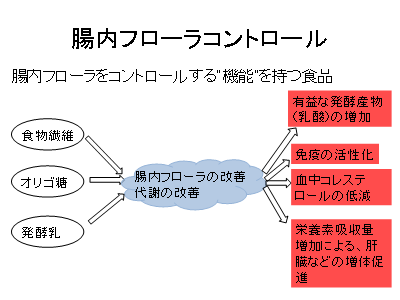
本年度の栄養生理学実験、後半ではオリゴ糖が単胃動物の健康および栄養に及ぼす影響について考えます。
オリゴ糖を含有する水を飲水させたラットの臓器、血液および大腸内容物を主な材料にして、健康と栄養状態を表す一連の指標を分析していきます。
初回は2週間のラットの飼育とサンプリングの様子をご紹介します。
今回の栄養生理学実験は以上です。3年生のみなさん、2週間のラットのお世話お疲れ様でした。
次からは今回サンプリングした血液と盲腸内容物の分析に入ります。
まずはじめは、血清成分(グルコース&コレステロール)の測定です。
それでは、次回もお楽しみに!
(担当:澤田)
第7回 血清成分の分析
本年度の栄養生理学実験、後半ではオリゴ糖が単胃動物の健康および栄養に及ぼす影響について考えます。
オリゴ糖を含有する水を飲水させたラットの臓器、血液および大腸内容物を主な材料にして、健康と栄養状態を表す一連の指標を分析していきます。
今回は測定キットを使って前回サンプリングした血液中のグルコースとコレステロール濃度を測ります。
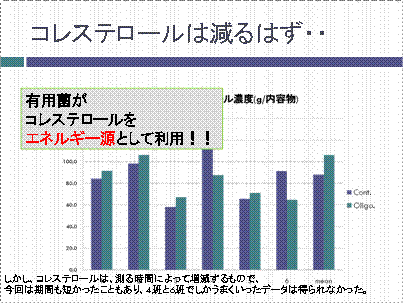
今回の栄養生理学実験は以上です。残念ながら、血液成分にオリゴ糖給与による影響は見られませんでした。
血液成分にまで効果が表れるには、飼育期間が短かったのかもしれません。
次からは重量に違いが見られた盲腸内容物の分析とあって効果が期待できます。
それでは、次回もお楽しみに!
(担当:澤田)
第8回 アンモニア態窒素濃度の測定
・・・またもや写真を撮り忘れてしまいましたのでお休みとさせていただきますm(_ _)m
第10回 SCFAの定量および嫌気性ロールチューブ法による腸内細菌の培養計数
本年度の栄養生理学実験、後半ではオリゴ糖が単胃動物の健康および栄養に及ぼす影響について考えます。
オリゴ糖を含有する水を飲水させたラットの臓器、血液および大腸内容物を主な材料にして、健康と栄養状態を表す一連の指標を分析していきます。
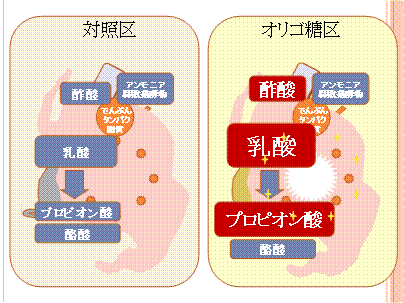
今回は盲腸内容物を用いて、SCFAのガスクロマトグラフ定量と総細菌、Clostridiaおよびcoliformsの培養計数を行いました。
オリゴ糖によって総細菌の数が増えSCFAも増える一方、Clostridiaおよびcoliformsといった悪玉菌は減ることを期待しています。
今回の栄養生理学実験は以上です。
次回はロールチューブ計数およびrt-PCRを行います。
次回もお楽しみに!
(担当:さかき)
第11回 ロールチューブ法およびReal-time PCR法による腸内細菌の定量
本年度の栄養生理学実験、後半ではオリゴ糖が単胃動物の健康および栄養に及ぼす影響について考えます。
オリゴ糖を含有する水を飲水させたラットの臓器、血液および大腸内容物を主な材料にして、健康と栄養状態を表す一連の指標を分析していきます。
これまでの実験でオリゴ糖添加することで盲腸内容物重の増加や発酵パターンが変化することを確認してきました。これらは、オリゴ糖添加により腸内に生息する微生物の構成が変化したことに起因するものと考えられます。
今回は2つの方法で腸内に生息する細菌を定量し、オリゴ糖添加による腸内細菌叢変化に関する理解を深めることが目的です。
1, ロールチューブ法による総細菌、Clostridium 属細菌およびColiforms の定量
前回の実験では培地を作製し、10倍希釈系列の盲腸内容物を培地に接種しました。
37℃で2日間培養するとコロニーができてくるので、それを1つずつ正確に数えていきます。
2, Real-time PCR法による盲腸内総細菌およびLactobacillus 属細菌の定量
ロールチューブの細菌計数と平行して、培養を行うことなく細菌の定量をすることができるReal-time PCR法による定量を行いました。
今回の栄養生理学実験は以上です。Real-time PCR法による結果ではオリゴ糖添加により菌叢が大きく変化したことが分かったと思います。
今回の結果はこれまでの結果とあわせて考えるとどのようなことがいえるでしょうか?
来週はいよいよ後半のプレゼン発表です!
それでは、次回もお楽しみに!
(担当:吉國)
プレゼンテーション(後半)
本年度の栄養生理学実験、後半ではオリゴ糖が単胃動物の健康および栄養に及ぼす影響について考えます。
オリゴ糖を含有する水を飲水させたラットの臓器、血液および大腸内容物を主な材料にして、
健康と栄養状態を表す一連の指標を分析していきます。
これまでの実験で給与飼料の違いにより、血中成分や腸内発酵パターンおよび腸内菌叢が異なることを確認してきました。
今回は後半のまとめとして、これまで行ってきた実験について班ごとに考察し、発表してもらいました。
みなさん、発表・準備お疲れ様でした。
いろいろコメントしてきましたが、どの班も個性豊かな発表でとても楽しかったです。
今後研究室に配属されるとプレゼンの機会も増えると思うので、どんどん技術を磨いていってください。
今年度の栄養生理学実験は以上です。
前半はヒツジ(反芻動物)、後半はラット(単胃動物)を用いてさまざまな実験を行ってきました。
3年生はどのようなことを感じたのでしょうか。
研究室分属も近づいていますが、どの研究室にいってもこの実験の経験が生きれば幸いです。
来年もお楽しみに!
(担当:すう)