名前を変えて全15回になったこの学生実験も今年で4度目です!
前半ではヒツジを、後半ではラットを用いて、動物が摂取した飼料がお腹の中でどう代謝されていくのかを考えます。
このページでは、慣れない実験に戸惑いながらも、がんばる初々しい3年生の模様をお伝えします。
第1回 ルーメン液のサンプリング、pH測定およびプロトゾア観察
前半のヒツジ(ルーメン)編では、粗飼料を多給した区と濃厚飼料を多給した区を設定し、それらの飼料がお腹の中でどのように分解・発酵されていくのかを見ていきます。
初回の実験では各ヒツジからルーメン液を採取し、pHを測定し、微生物の一種であるプロトゾアを観察しました。
サンプリングは継時変化を見るため、給餌前、給餌後1、2、3、4時間と5回に分けて行いました。
来週は濃厚飼料を多給したヒツジからルーメン液を採取します。
今回の粗飼料多給時とはまた違うルーメン液の臭いや発酵状態にもぜひ着目してみてください。
それでは、次回もお楽しみに!
(担当:若井)
第2回 糖質分解酵素の活性測定
前半のヒツジ(ルーメン)編では、粗飼料を多給した区と濃厚飼料を多給した区を設定し、それらの飼料がお腹の中でどのように分解・発酵されていくのかを見ていきます。
2回目の実験では採取したルーメン液の糖質分解酵素の活性を測定し、ルーメン内で粗飼料および濃厚飼料が分解されることを実証しました。
今回の栄養生理学実験は以上です。
次回はSCFA濃度とアンモニア態窒素濃度の測定です。
次回もお楽しみに!
(担当:近田)
第3回 SCFA濃度とアンモニア態窒素濃度の測定
前半のヒツジ(ルーメン)編では、粗飼料を多給した区と濃厚飼料を多給した区を設定し、それらの飼料がお腹の中でどのように分解・発酵されていくのかを見ていきます。
3回目の実験では、採取したルーメン液の短鎖脂肪酸(SCFA)とアンモニア態窒素濃度を測定し、飼料中の炭水化物が宿主動物のエネルギー源に変換されることを理解し、微生物タンパク質の合成に必要なアンモニアが生成されていることを確認しました。
今回の栄養生理学実験は以上です。
次回もお楽しみに!
(担当:近田)
第4回 PCR-RFLPによる菌叢解析
この回では、前々回にDNA抽出~PCRで増幅したPCR産物を制限酵素により消化し、バンドパターンの違いから菌叢変化を類推していきます。
飼養条件の違いにより、バンドパターンに明確な違いは見られるか。PCR同様DNAを扱うミクロな実験なので、コンタミが起こらないよう細心の注意を払いつつ行う必要があります。
今回の実験では、残念ながら期待した結果は見られませんでした。
ただ、代謝産物など他のパラメーターで大きな違いが出ているので菌叢変化が起こっていることは確かです。
より詳細に調べていけば違いが見られたかもしれませんね!
次回はいよいよ前半戦の最終回プレゼンテーションです。
これまで、実験して得られた結果をまとめて人にわかりやすく説明する能力を付けるための良い訓練です。
それでは、次回もお楽しみに!
(担当:近田)
第5回 PCR-RFLPによる菌叢解析
この回では、前々回にDNA抽出~PCRで増幅したPCR産物を制限酵素により消化し、バンドパターンの違いから菌叢変化を類推していきます。
飼養条件の違いにより、バンドパターンに明確な違いは見られるか。PCR同様DNAを扱うミクロな実験なので、コンタミが起こらないよう細心の注意を払いつつ行う必要があります。
今回の実験では、残念ながら期待した結果は見られませんでした。
ただ、代謝産物など他のパラメーターで大きな違いが出ているので菌叢変化が起こっていることは確かです。
より詳細に調べていけば違いが見られたかもしれませんね!
次回はいよいよ前半戦の最終回プレゼンテーションです。
これまで、実験して得られた結果をまとめて人にわかりやすく説明する能力を付けるための良い訓練です。
それでは、次回もお楽しみに!
(担当:近田)
第6回 プレゼンテーション(前半)
前半のヒツジ(ルーメン)編では、粗飼料を多給した区と濃厚飼料を多給した区を設定し、それらの飼料がお腹の中でどのように分解・発酵されていくのかを見ていきます。
これまでの実験で、給与飼料の違いによりルーメン内の発酵パターンが変化することを確認してきました。また、なぜ変化が起きているのか、ルーメン内微生物に着目して数・多様性・酵素活性を明らかにしてきました。
今回は、前半のまとめとしてこれまで行ってきた実験の結果・考察を班ごとに発表してもらいました。
前半の栄養生理学実験は以上です。
次回からはオリゴ糖がラット(単胃動物)に与える影響を見ていきます。
次回もお楽しみに!
(担当:近田)
第7回 ラット体重測定・群分け、管理当番振り分け、試験意義の説明
実験後半では単胃動物の下部消化管(主に盲腸)をターゲットにしていきます。
この後半の一連の試験にはラットを用いるため、この回には体重測定と群分けを行いました。
果たしてオリゴ糖とビフィズス菌はラット盲腸内発酵に好ましい影響を与えるのでしょうか?
次回はラットからサンプルを採取し、各器官の測定を行います。
それでは次回もお楽しみに!
(担当:近田)
第8回 諸器官計測、サンプル採取
前半の最初と同じく、後半もまずはサンプルの採取から始まります。
今回は、1週間オリゴ糖とビフィズス菌を給与したラットから、血液と盲腸内容物を採取します。
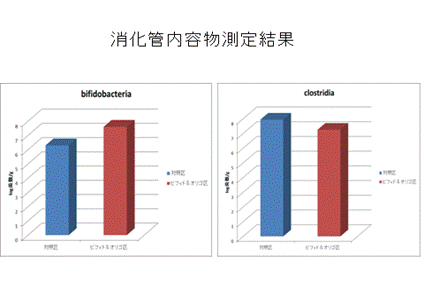
さらに、腑分けも行い、各臓器・組織重量、消化管内容物重を測定し、オリゴ糖とビフィズス菌の給与による影響を検証します。
血液採取や腑分けなど、慣れない作業ばかりでしたが、いかがだったでしょうか?
動物を使った実験というのを改めて理解するきっかけになったのではないでしょうか。
今後は採取したサンプルを分析し、オリゴ糖とビフィズス菌の効果を検証していきます。
次回以降の結果に期待しましょう。
それでは、次回もお楽しみに!
(担当:近田)
第9回 血中コレステロール、グルコースの定量および盲腸内pHの測定
今回は、ラットから採血→遠心分離して得られた血清を元に血中グルコースおよびコレステロールの濃度を測定します。
測定原理の詳細は長くなるので控えますが、それぞれの存在量を専用のキットを用いて調べます。
実際の操作は前半戦のアンモニア態窒素濃度測定などと同様にプレートリーダーを使った比色定量です。
キットを使っているので作業工程は非常に簡便化されていますが、扱う試薬の容量が少ないのでピペッティング操作に慣れない3年生は毎年苦戦します。
1μℓや0.75μℓという試薬のアプライ量に苦戦していた班も多かったようです。
結果として血中コレステロール、グルコース濃度には違いは出ていたのでしょうか。
次回は盲腸内の代謝産物濃度としてアンモニア態窒素および乳酸濃度を測定します。
それでは、次回もお楽しみに!
(担当:近田)
第10回 アンモニア態窒素および乳酸濃度測定
今回は、オリゴ糖&ビフィズス菌を給与したラットの盲腸内容物より、アンモニア態窒素と乳酸の濃度、pHを測定しました。
オリゴ糖&ビフィズス菌給与が腸内フローラに影響を与えているか、その代謝産物を見ることで間接的に推測します。
試薬分注の多い実験、おつかれさまでした。
目に見えない微生物のはたらきを、アンモニア態窒素や乳酸といった代謝産物を通して実感していただけたでしょうか。
次回は、ロールチューブ法による腸内菌の培養計数およびVFA濃度測定です。
それでは、次回もお楽しみに!
(担当:近田)
第11回 嫌気性ロールチューブ法による腸内細菌の培養計数およびラット盲腸内SCFA濃度測定
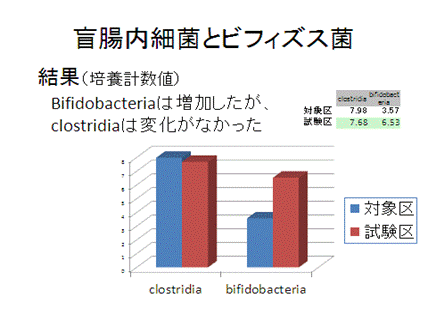
今回は、ラットの盲腸内容より総嫌気性細菌、Clostridiaおよびビフィズス菌の培養計数準備としてロールチューブを作成しました。
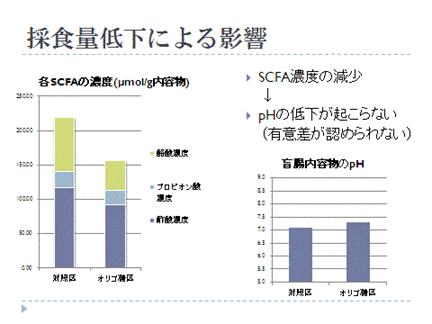
また、発酵パターンのちがいを見るため短鎖脂肪酸(SCFA)濃度の測定も行いました。
今回の栄養生理学実験の様子は以上です。
SCFA濃度のちがいからオリゴ糖&ビフィズス菌給与にどんな効果があるのか、少しわかってきたのではないでしょうか?
次回はロールチューブに出現したコロニーの計数と「培養を必要としない」定量法であるreal-time PCRで
腸内細菌の変化を追ってもらいます。
それでは、次回もお楽しみに!
(担当:近田)
第12回 real-time PCR法およびロールチューブ法による腸内嫌気性細菌の定量
オリゴ糖とビフィズス菌が単胃動物の健康および影響に及ぼす影響を探る旅!
いよいよ本実験も大詰めとなりました。
今回は、前回作成したロールチューブに出現したコロニーを数える培養計数とreal-time PCRによる非培養定量法で腸内細菌の変化をみていきます。
オリゴ糖とビフィズス菌の給与により腸内細菌叢はどのうように変化したのでしょうか?
今回の栄養生理学実験の様子は以上です。
ロールチューブのコロニー計数という作業自体は単純なものですが、盲腸内容物を使ってコロニーが形成されている状態を観察できたことで腸内細菌のはたらきを知ることの有用性を再確認できたのではないでしょうか?
またreal-time PCRという先端技術を使った定量もよい経験になりましたね。
次回はとうとう後半の最後。そして栄養生理学実験の最終回です!後半の実験のまとめとしてプレゼンを行ってもらいます。
それでは、次回もお楽しみに!
(担当:近田)
第13回 プレゼンテーション(後半)
オリゴ糖とビフィズス菌が単胃動物の健康および影響に及ぼす影響を探る旅を終えてまとめのプレゼンです!
3年生はどんな発表をしてくれるのでしょうか?
今回の栄養生理学実験の様子は以上です。
1か月にわたる実験の内容を分かりやすくまとめて、かつ人に伝えるという作業は難しかったと思いますがこの経験はこの先必ず生きてくるはずです。
それはどの研究室に配属されても同じことです。社会に出てからもこういったプレゼン力というのは必要です。
ここで得た経験を忘れずにがんばっていってください!
実験、発表お疲れ様でした!
(担当:近田)