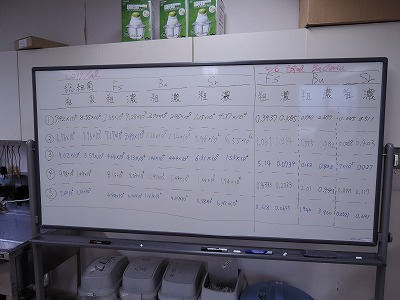
この授業では、前半はヒツジ(反芻動物)、後半はラット(単胃動物)を用いて、動物が摂取した飼料がお腹の中でどう代謝されていくのかを考えます。
慣れない実験に戸惑いながらも、がんばる初々しい3年生の模様をお伝えします。
第1回 ルーメン内容物サンプリング、pH測定およびプロトゾア観察
前半のヒツジ(反芻動物)編では、ルーメン液を採取した後、粗飼料多給と濃厚飼料多給を模した条件で培養し、培養液中に含まれる微生物や発酵産物の解析から、反芻動物のルーメン発酵について考えていきます。
初回の実験ではヒツジからルーメン液を採取し、pHを測定、微生物の一種であるプロトゾアを観察しました。
来週は粗飼料多給区、濃厚飼料多給区それぞれの糖質分解酵素の活性を見ていきます。
実験の基礎であるピペッティングを実践するとともに、酵素による飼料の分解について調べていきます。
それでは、次回もお楽しみに!
(担当:岸)
第2回 糖質分解酵素の活性測定
前半のヒツジ(反芻動物)編では、ルーメン液を採取した後、粗飼料多給と濃厚飼料多給を模した条件で培養し、培養液中に含まれる微生物や発酵産物の解析から、反芻動物のルーメン発酵について考えていきます。
2回目の実験ではin vitro培養サンプルの糖質分解酵素(アミラーゼ・セルラーゼ)の活性を測定し、粗飼料多給条件および濃厚飼料多給条件でこれらの酵素活性がどのように異なるのかを確認しました。
今回の栄養生理学実験は以上です。
次回はSCFA濃度、アンモニア態窒素濃度の測定を行います。
それでは、次回もお楽しみに!
(担当:岸)
第3回 SCFA濃度およびアンモニア態窒素濃度の測定
前半のヒツジ(反芻動物)編では、ルーメン液を採取した後、粗飼料多給と濃厚飼料多給を模した条件で培養し、培養液中に含まれる微生物や発酵産物の解析から、反芻動物のルーメン発酵について考えていきます。
3回目の実験では、短鎖脂肪酸(SCFA)とアンモニア態窒素濃度を測定し、飼料中の糖質が宿主動物のエネルギー源に変換されることを理解し、微生物タンパク質の合成に必要なアンモニアが生成されていることを確認しました。
今回の栄養生理学実験は以上です。
次回はルーメン細菌からのDNA抽出とPCR、電気泳動を行います。
それでは、次回もお楽しみに!
(担当:岸)
第4回 ルーメン細菌からのDNA抽出とPCR反応
前半のヒツジ(ルーメン)編では、粗飼料を多給した区と濃厚飼料を多給した区を設定し、それらの飼料がお腹の中でどのように分解・発酵されていくのかを見ていきます。
今回は、ヒツジの第一胃(ルーメン)で大事なはたらきをしているルーメン細菌の叢がどのように変化しているのかを探る第一ステップとしてルーメン内容物からのDNA抽出とPCRを行いました。
今回の栄養生理学実験は以上です。
次回はルーメンから離れて、単胃動物であるラットの給与試験の準備としてラットの群分けを行います。
それでは、次回もお楽しみに!
(担当:秋山)
第5回 ラットの体重測定・群分け
後半のラット(単胃動物)編では、不溶性繊維もしくは水溶性繊維の精製飼料を給与したラットを用いて、健康と栄養状態を表す一連の指標を分析しながら、食物繊維の効果について考えていきます。
5回目の実験では、5週齢のSDラット10個体を体重測定し、2群に分けました。
これから3週間、このラットたちをお世話していきます。
今回の栄養生理学実験は以上です。
次回はルーメン内の細菌をリアルタイムPCRを用いて定量し、菌叢解析を行います。
それでは、次回もお楽しみに!
(担当:秋山)
第6回 Real‐time PCRによる繊維分解菌と可溶性糖類利用菌の定量
前半のヒツジ(ルーメン)編では、粗飼料を多給した区と濃厚飼料を多給した区を設定し、それらの飼料がお腹の中でどのように分解・発酵されていくのかを見ていきます。
これまでの実験では、粗肥料と濃厚飼料のバランスを変えると、短鎖脂肪酸、アンモニア態窒素に違いが出ることを確認しました。これは、それぞれの飼料分解に関与するルーメン細菌の種類が異なるためです。
今回の実験では、ルーメン内で代表的な繊維分解菌、可溶性糖類利用菌および総細菌をReal‐time PCRにより定量し、それぞれの細菌種の動態をモニターしました。
今回の栄養生理学実験は以上です。
次回は前半の実験のまとめとして各班でプレゼンテーションを行った様子を、お伝えします。
それでは、次回もお楽しみに!
(担当:秋山)
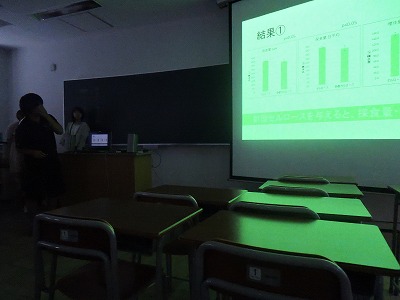
第7回 プレゼンテーション
前半のヒツジ(ルーメン)編では、採取したルーメン液を採取した後、試験管内に粗飼料を多給した区と濃厚飼料を多給した区を設定し、試験管内のルーメン液に含まれる微生物による飼料の分解・発酵の解析から、お腹の中の発酵について考えていきます。
今回は、前半のまとめとしてこれまで行ってきた実験の結果・考察を班ごとに発表してもらいました。
今回の栄養生理学実験は以上です。
次回からは水溶性もしくは不溶性の食物繊維がラット(単胃動物)に与える影響を見ていきます。
それでは、次回もお楽しみに!
(担当:上野)
第8回 ラット諸器官計測、サンプル採取
3週間にわたり、ラットの給与試験を行ってきました。
今回は、そのラットから血液と盲腸内容物を採取します。
さらに、腑分けも行い、各臓器・組織重量、消化管内容物重を測定し、飼料による腸内環境への影響を検証します。
今回の栄養生理学実験は以上です。
今後は採取したサンプルを分析し、水溶性および不溶性食物繊維が腸内環境に与える影響をいろいろな角度から検証していきます。
それでは、次回もお楽しみに!
(担当:秋山)
第9回 ラットの血中グルコース・コレステロール濃度測定
後半のラット(単胃動物)編では、水溶性もしくは不溶性食物繊維を含む精製飼料を給与したラットを用いて、健康と栄養状態を表す一連の指標を分析しながら、食物繊維の効果について考えていきます。
ラット解剖後初となる今回の実験では、心臓から採血した血液を用い、その中のグルコース・コレステロールの濃度を測ります。
今回の栄養生理学実験は以上です。
次回は盲腸内容物に含まれる乳酸およびアンモニア態窒素濃度の測定を行います。
それでは、次回もお楽しみに!
(担当:岸)
第10回 アンモニア態窒素、乳酸、pHの測定
3週間にわたり、ラットの給与試験を行ってきました。今回は、そのラットの盲腸内容物のアンモニア態窒素、乳酸、pHの測定し、飼料の違いが腸内フローラに与える影響を検証します。
今回の栄養生理学実験は以上です。
次回はロールチューブ法による腸内菌の培養計数およびSCFA濃度測定です。
それでは、次回もお楽しみに!
(担当:岸)
第11回 ラット盲腸内SCFA濃度測定および、嫌気性ロールチューブの作成
3週間にわたり、ラットの給与試験を行ってきました。
今回は、ガスクロマトグラフィーを用いて盲腸内容物のSCFAを測定します。
また、嫌気的環境下における生菌数を測定するためにロールチューブの作成を行います。
今回の栄養生理学実験は以上です。
次回は今回作成したロールチューブのコロニー数測定と腐敗産物インドール・スカトールの測定です。
それでは、次回もお楽しみに!
(担当:秋山)
第12回 ロールチューブのコロニー数測定と腐敗産物インドール・スカトールの測定
3週間にわたり、ラットの給与試験を行ってきました。
今回は、前回作成したロールチューブについて、出現したコロニーを計測します。
また、腐敗産物であるインドール・スカトールの測定を行います。
腸内細菌叢の変化は見られるのでしょうか?
今回の栄養生理学実験は以上です。
次回は後半の最後、栄養生理学実験の最終回となります。
今までの実験で得られた結果をもとに、水溶性食物繊維の効果について発表を行います。
それでは、次回もお楽しみに!
(担当:秋山)
第13回 プレゼンテーション
3週間にわたり、ラットの給与試験を行ってきました。
今回はいよいよ最終回、今までの実験結果・考察を班ごとにまとめて発表してもらいました。
今回の栄養生理学実験は以上です。
1ヶ月にわたる実験の内容を分かりやすくまとめて、かつ人に伝えるという作業は難しかったと思いますが、スライドの作り方や説明の仕方は格段に上手になっていました。
今後の研究室生活だけに限らず、どんな場所においてもプレゼン力は必要とされます。
ここで得た経験を忘れずに、これからも技術を磨いていってください!
実験、発表お疲れ様でした!
(担当:秋山)